1.- FORMULACIÓN INORGÁNICA
2.- EXÁMENES
3.- LABORATORIO
1- FORMULACIÓN INORGÁNICA
Debes empezar aprendiendo el Sistema Periódico y las valencias de los elementos. A continuación, estudia la formulación de cada tipo de compuesto comprendiendo los ejemplos y realizando los ejercicios que se te proponen.
Sistema Periódico
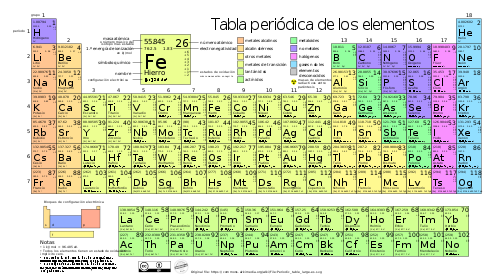
Valencias
La valencia o número de oxidación de un elemento indica su capacidad de combinación con otros elementos para formar los compuestos. Distinguimos entre:
electrovalencia: (número de electrones ganados -valencia negativa-, o perdidos -positiva-, por el elemento, en la formación de un enlace iónico.
covalencia: número de enlaces covalentes que puede formar el elemento.
A continuación se muestran las principales valencias de los elementos. Antes de continuar con la formulación, debes hacer el esfuerzo de aprendértelas.
| Grupo | Familia | Valencias |
| 1A | Alcalinos | 1 (El H también -1) |
| 2A | Alcalinotérreos | 2 |
| 3A | Térreos | 3 |
| 4A | Carbonoideos | 2, 4 (El C también -4) |
| 5A | Nitrogenoideos | -3 1,3,5 |
| 6A | Anfígenos | -2 2,4,6 El O sólo -2, -1(peróxidos) y 2 (con el F) |
| 7A | Halógenos | -1 1,3,5,7 El F sólo -1 |
| 0 | Gases nobles | 0 |
| 3B | Sc, Y, La, Ac | 3 |
| 4B | Ti Zr, Hf | 2, 3, 4 4 |
| 5B | V Nb Ta | 2, 3, 5 3, 5 5 |
| 6B | Cr Mo, W | 2, 3 (como metal) 3, 6 (no metal) 6 |
| 7B | Mn Tc, Re | 2, 3, 4 (como metal) 6, 7 (no metal) 4, 6, 7 |
| 8 | Fe Ru Os | 2, 3 3 3, 4 |
| 8 | Co Rh Ir | 2, 3 3 3, 4 |
| 8 | Ni Pd, Pt | 2, 3 2, 4 |
| 1B | Cu Ag Au | 1, 2 1 1, 3 |
| 2B | Zn, Cd Hg | 2 1, 2 |
| Iones | CN– (cianuro) NH4+ (amonio) | -1 1 |
Ru, Os, Rh, Ir, aunque se han incluido, no los utilizarás normalmente. Forman compuestos de coordinación, que no estudiaremos.
Esquema de formulación
Este esquema es sólo nemotécnico, y no indica la forma real de obtención de cada compuesto.
| oxígeno + | metal: no metal: | óxido anhídrido | + H2O: | hidróxido oxácido | -H +metal: | oxisal |
| hidrógeno + | metal: no metal: | hidruro metálico hidruro no metálico. de halógenos y anfígenos: | hidrácidos | – H + metal: | sal binaria si halógeno: | haluro |
Óxidos y anhídridos.
Son las combinaciones del oxígeno con otro elemento. Si éste es metálico, se trata de un óxido básico, o simplemente óxido, y si es un no metal, de un óxido ácido o anhídrido.
Para formularlos, se intercambian los valores de las respectivas valencias, que se ponen como subíndices, simplificando si se puede.
Este procedimiento se vuelve a dar en la formulación de hidróxidos, sales, etc.
Los subíndices obtenidos después de la simplificación representan el número de átomos (o de grupos), existentes en el compuesto.
Intercambio de valencias a subíndices
Tradicional.
Los óxidos se denominan con el término óxido y el nombre del metal acabado en oso (valencia menor) o ico (mayor).
Los anhídridos se nombran con el término anhídrido y el nombre del no metal, acabado en:
a/ oso o ico (en el caso de dos valencias)
b/ hipo-no metal-oso, oso, ico (tres valencias)
c/ hipo-no metal-oso, oso, ico, per-no metal-ico (si tienecuatro valencias).
Stock.
Se nombran con el término óxido de, seguido del nombre del metal o no metal, y a continuación, entre paréntesis, el número de oxidación de éste.
Sistemática.
Escribe el prefijo indicativo del número de átomos de oxígeno, seguido del término óxido de, y a continuación el prefijo correspondiente al número de átomos del metal o no metal, y su nombre.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| Fe2O3 | Óxido férrico | Óxido de hierro (III) | Trióxido de dihierro |
| CaO | Óxido cálcico | Óxido de calcio | Óxido de calcio |
| Cl2O3 | Anhídrido cloroso | Óxido de cloro (III) | Trióxido de dicloro |
Peróxidos
Son aquellas combinaciones de metales con el oxígeno, en que éste presenta la estructura O22- ( -O-O-2-).
El número de oxidación del O en estos compuestos es –1
Para formularlos basta con añadir un O al correspondiente óxido, sin simplificar.
Tradicional.
Se nombran con el término peróxido, seguido del nombre del metal acabado en oso (valencia menor) o ico (mayor).
Stock
Con el término peróxido, el nombre del metal y su valencia entre paréntesis, en números romanos.
Sistemática
Mediante los prefijos indicativos del número de átomos de O y de metal.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| K2O2 | Peróxido potásico | Peróxido de potasio | Dióxido de dipotasio |
| H2O2 | Agua oxigenada | Peróxido de hidrógeno | Dióxido de dihidrógeno |
| BaO2 | Peróxido de bario | Peróxido de bario | Dióxido de bario |
| CuO2 | Peróxido cúprico | Peróxido de cobre(II) | Dióxido de cobre |
| ZnO2 | Peróxido de cinc | Peróxido de cinc | Dióxido de cinc |
Hidruros
Son las combinaciones del hidrógeno con otro elemento.
Cuando es con un metal se trata de u hidruro metálico, y en caso contrario, de un hidruro no metálico. Dentro de éstos, los que forman los halógenos y anfígenos se denominan hidrácidos, debido al carácter ácido de sus disoluciones acuosas.
A/ Hidruros metálicos. En ellos el H actúa con número de oxidación -1. El metal se escribe en primer lugar.
Tradicional.
Se nombran con el término hidruro, seguido del nombre del metal acabado en oso o ico.
Stock
Con el término hidruro de seguido del nombre del metal y entre paréntesis su valencia.
Sistemática.
Mediante el prefijo indicativo del número de átomos de H que posee.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| NaH | Hidruro de sodio | Hidruro de sodio | Hidruro de sodio |
| CaH2 | Hidruro de calcio | Hidruro de calcio | Dihidruro de calcio |
| FeH3 | Hidruro férrico | Dihidruro de hierro(III) | Trihidruro de hierro |
B/ Hidruros no metálicos. El hidrógeno actúa con valencia 1.
§ Los hidruros de los halógenos y anfígenos se denominan hidrácidos.
Tradicional
Se nombran con el término ácido seguido del nombre del no metal acabado en hídrico. También con el nombre del no metal acabado en uro y la expresión de hidrógeno.
| Tradicional | Sistemática | |
| HF | Ácido fluorhídrico | Fluoruro de hidrógeno |
| HCl | Ácido clorhídrico | Cloruro de hidrógeno |
| HBr | Ácido bromhírico | Bromuro de hidrógeno |
| HI | Ácido yodhídrico | Yoduro de hidrógeno |
| H2S | Ácido sulfhídrico | Sulfuro de hidrógeno |
| H2Se | Ácido selenhídrico | Seleniuro de hidrógeno |
| H2Te | Ácido telurhídrico | Telururo de hidrógeno |
Los hidruros de B, C, Si y del grupo de los nitrogenoideos, se formulan escribiendo el H en segundo lugar. El no metal actúa con valencia -3 o -4. Se nombran de forma especial:
| Tradicional | Sistemática | |
| BH3 (en realidad B2H6) | borano | Trihidruro de boro |
| CH4 | metano | Tetrahidruro de carbono |
| SiH4 | silano | Tetrahidruro de silicio |
| NH3 | amoníaco | Trihidruro de nitrógeno |
| PH3 | fosfina | Trihidruro de fósforo |
| AsH3 | arsina | Trihidruro de arsénico |
| SbH3 | estibina | Trihidruro de antimonio |
| BiH3 | bismutina | Trihidruro de bismuto |
Sales binarias
Están formadas por metal y no metal. Cuando el no metal es un halógeno, reciben el nombre de haluros.
Se pueden considerar el resultado de sustituir el H de los hidrácidos por un metal.
Esto es lo que ocurre en la reacción general:
ÁCIDO + BASE ——— SAL + H2O
en donde, en este caso, el ácido es un hidrácido, la base (o hidróxido), el tipo de compuestos que estudiaremos a continuación y la sal una sal binaria.
Tradicional
Se nombran con el nombre del no metal acabado en uro, el termino de, y el nombre del metal acabado en oso o ico.
Stock
Nombre del no metal, acabado en uro, seguido del término de, y el nombre del metal con su valencia entre paréntesis en números romanos.
Sistemática.
Se indica con un prefijo el número de átomos del no metal, a continuación el nombre de éste,., el prefijo correspondiente al número de átomos de metal y su nombre.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| NaCl | Cloruro de sodio | Cloruro de sodio | Cloruro de sodio |
| CaBr2 | Bromuro cálcico | Bromuro de calcio | Dibromuro de calcio |
| Ni3N2 | Nitruro niqueloso | Nitruro de niquel(II) | Dinitruro de triniquel |
| Li2S | Sulfuro de litio | Sulfuro de litio | Sulfuro de dilitio |
Hidróxidos
Se denominan tambien bases. Están formados por la combinación del anión hidróxido (OH-) y un catión metálico -o poliatómico que se comporte como tal (como el NH4 +)-.
Como acabamos de ver, reaccionan con los ácidos para formar sales.
Tradicional.
Se nombran con el término hidróxido y a continuación el nombre del metal, acabado cuando sea necesario en oso o ico.
Stock
Término hidróxido seguido del nombre del metal y su valencia en números romanos entre paréntesis. Si el metal sólo tiene una valencia se omite.
Sistemática.
Se indica el número de hidróxidos mediante un prefijo, a continuación el término hidróxido y el nombre del metal. El prefijo mono se omite.
Oxácidos
Se pueden considerar derivados de los óxidos ácidos (anhídridos), por adición de agua.
Lo normal es que el anhídrido adicione 1 molécula de H2O, pero hay algunos elementos que pueden adicionar 1, 2 ó 3. Éstos son P, As, Sb y B.
Como ocurría con los hidrácidos, reaccionan con los hidróxidos o bases para formar la correspondiente sal. En este caso una oxisal.
Tradicional.
Se nombran como el anhídrido correspondiente, cambiando el término anhídrido por el término ácido.
En el caso de los ácidos polihidratados, se utilizan los prefijos meta (1 molécula de agua), piro ó di (2 moléculas) y orto (3). Este último se suele omitir.
Stock
Término ácido, seguido del prefijo indicativo del número de O, el nombre del anión acabado en ico y el número de oxidación del no metal entre paréntesis en números romanos.
Sistemática.
Se equiparan a las sales (que veremos posteriormente), nombrándolos mediante el prefijo indicativo del número de O, el término oxo, el nombre del anión acabado en ato y el término de hidrógeno.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| H2SO4 | Ác. Sulfúrico | Ác. Tetraoxosulfúrico(VI) | Tetraoxosulfato(VI) de hidrógeno |
| HNO3 | Ác. Nítrico | Ác. Troxonítrico(V) | Trioxonitrato(V) de hidrógeno |
| HClO3 | Ác. Clórico | Ác. Trioxoclórico(V) | Trioxoclorato(V) de hidrógeno |
| H3PO4 | Ác. Fosfórico | Ác. Tetraoxofosfórico(V) | Tetraoxofosfato(V) de hidrógeno |
| H2CO3 | Ác. Carbónico | Ác. Trioxocarbónico | Trioxocarbonato de hidrógeno |
| HNO2 | Ác. Nitroso | Ác. Dioxonítrico(III) | Dioxonitrato(III) de hidrógeno |
| HClO4 | Ác. Perclórico | Ác. Tetraoxoclórico(VII) | Tetraoxoclorato(VII) de hidrógeno |
| HmnO4 | Ác. Permangánico | Ác. Tetraoxomangánico(VII) | Tetraoxomanganato(VII) de hidrógeno |
Poliácidos
Resultan de la unión de dos o más moléculas de ácido con pérdida de una molécula de H2O en cada unión.
Tradicional
Se nombran con un prefijo indicativo del número de moléculas de ácido que se unieron, y el nombre del correspondiente ácido sencillo.
Stock y sistemática.
Siguen el mismo procedimiento que para los oxácidos simples, indicando con un prefijo el número de átomos del no metal que contienen.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| H2S2O7 | Ácido disulfúrico | Ác. Heptaoxodisulfúrico(VI) | Heptaoxodisulfato(VI) de hidrógeno |
| H2Cr2O7 | Ácido drcrómico | Ác. Heptaoxodicrómico(VI) | Heptaoxodicromato(VI) de hidrógeno |
| H2C2O5 | Ácido dicarbónico | Ác. Pentaoxodicarbónico(IV) | Pentaoxodicarbonato(IV) de hidrógeno |
| H2C3O7 | Ácido tricarbónico | Ac. Heptaoxotricarbónico(IV) | Heptaoxotricarbonato(IV) de hidrógeno |
Peroxoácidos
Son el resultado de la sustitución de un oxígeno de los axácidos por el grupo peroxo (O22-). Como ocurría con los peróxidos, no se simplifica.
Se nombran anteponiendo el término peróxido al nombre del correspondiente oxácido.
Ejemplos: H2SO5 ácido peroxosulfúrico , H2S2O8 ácido peroxodisulfúrico , H4P2O8 ácido peroxodifosfórico
Tioácidos
Resultan de la sustitución de uno o más oxígenos por azufres en los oxácidos.
Tradicional
El número de sustituciones se indica con prefijos. No se simplifica.
Stock y sistemática
Añaden el término peroxo al término oxo de los correspondientes oxiácidos.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| H2SO5 | Ác. Peroxosulfurico | .ac. trioxoperoxosulfúrico(VI) | Trioxoperoxosulfato(VI) de hidrógeno |
| H2S2O8 | Ác. Peroxodisulfúrico | Ác. Hexaoxoperoxodisulfúrico(VI) | Hexaoxoperoxodisulfato(VI) de hidrógeno |
| H3PO5 | Ac. Peroxofosfórico | Ác. Trioxoperoxofosfórico(V) | Trioxoperoxofosfato(V) de hidrógeno |
| H4P2O8 | Ác. Peroxodifosfórico | Ác. Hexaoxoperoxodifosfórico(v) | Hexaoxoperoxodifosfato(V) de hidrógeno |
| HNO4 | Ác. Peroxonítrico | Ác. Dioxoperoxonítrico(V) | Dioxoperoxonitrato(V) de hidrógeno |
| H2CO4 | Ác. Peroxocarbónico | Ác. dioxoperoxocarbónico | Dioxoperoxocarbonato de hidrógeno |
| H3BO4 | Ác. peroxobórico | Ác. monoperoxobórico | Monoperoxoborato de hidrógeno |
Oxosales
Son el resultado de la sustitución total (sales neutras) o parcial (sales ácidas), de los hidrógenos de los oxácidos por metal.
Como vimos al estudiar los hidróxidos o bases, y los oxácidos, se obtienen de la reacción entre ambos tipos de compuestos.
Tradicional
Se nombran con el nombre del ácido correspondiente (omitiendo el término ácido), y cambiando las terminaciones en la forma:
| hipo – oso | —— | hipo – ito |
| oso | —— | ito |
| ico | —— | ato |
| per – ico | —— | per – ato |
Stock
Se nombra el anión, seguido del término de, el nombre del metal y su valencia, en números romanos, entre paréntesis.
Sistemática.
Se usa un prefijo para indicar el número de veces que aparece el anión: bis, tris, tetraquis, pentaquis,…, el prefijo indicativo del número de O, el término oxo y el nombre del anión acabado en ato, con el número indicativo de la valencia del no metal (según Stock), seguido del término de y el nombre del metal.
Ejemplos:
| Tradicional | Stock | Sistemática | |
| Co(NO3)2 | Nitrato cobaltoso | Nitrato de cobalto(II) | Bistrioxonitrato(V) de cobalto |
| Pt(CO3)2 | Carbonato platínico | Carbonato de platino(IV) | Bistrioxocarbonato de platino |
| Au(ClO3)3 | Clorato áurico | Clorato de oro(III) | Tristrioxoclorato(V) de oro |
Oxosales ácidas
Como comentamos en el apartado anterior son aquellas en que no se han sustituído por metal todos los hidrógenos del oxácido correspondiente.
Tradicional
Se nombran como la sal neutra, pero anteponiendo al nombre del metal un prefijo indicativo del número de hidrógenos que no se han sustituído.
Cuando se han sustituído la mitad de los hidrógenos, a veces se utiliza el prefijo bi.
Ejemplos: NaH2PO4 fosfato diácido de sodio , Na2HPO4 fosfato ácido de sodio , NaHCO3 carbonato ácido de sodio (o bicarbonato sódico) , Al(HSO4)3 sulfato ácido de aluminio (o bisulfato alumínico).
2- EXÁMENES:
Aquí tenéis una recopilación de problemas de Física y Química. Esperamos que «disfrutéis» con su resolución
